Mechanismus der neurodegenerationsbedingten Proteinaggregation

Die Fehlfaltung und Aggregation von Proteinen ist ein Schlüsselereignis in der Pathogenese neurodegenerativer Krankheiten wie Alzheimer und Parkinson und wird weithin als geeignetes Ziel für die Entwicklung von Medikamenten gegen Neurodegeneration angesehen. In unserer Gruppe setzen wir die NMR-Spektroskopie im Lösungszustand in Kombination mit anderen biophysikalischen und computergestützten Techniken ein, um hochauflösende mechanistische Erkenntnisse über die Proteinaggregation zu gewinnen. Ein besonderer Schwerpunkt unserer Forschung ist die Entwicklung neuer NMR-Methoden, z. B. Hochdruck-NMR, Einzelzustands-NMR, Fluor- und paramagnetische NMR, um unseren experimentellen Zugang zu den der Aggregation zugrunde liegenden Proteinbewegungen zu erweitern. Das derzeitige System, das uns interessiert, ist das mit der Alzheimer-Krankheit verbundene Amyloid-beta-Peptid, an dem wir die maßgeschneiderten NMR-Methoden anwenden, um zu untersuchen, wie seine Struktur, Dynamik, Stabilität und Aggregation durch Alzheimer-bedingte Mutationen, Modifikationen (z. B. Phosphorylierung) und Metall-, Peptid- und Kleinmolekülbindungen verändert werden.
Weitere Einzelheiten entnehmen Sie bitte unseren Publikationen.
Biomolekulare Phasentrennung

Die räumliche Anordnung von zellulären Komponenten und Aktivitäten wird häufig durch einen Prozess erreicht, der als Flüssig-Flüssig-Phasentrennung (LLPS) bekannt ist. Die durch LLPS gebildeten membranlosen Körper bieten eine für die Aktivität ihrer biomolekularen Komponenten geeignete Mikroumgebung. In unserer Gruppe sind wir an der Entwicklung neuer NMR-Methoden zur Charakterisierung der biomolekularen Phasentrennung interessiert, insbesondere im Hinblick auf die interne Fluidität und den Austausch von Komponenten in biomolekularen Kondensaten sowie auf die Mechanismen, die ihrer Bildung, Reifung und Auflösung zugrunde liegen. Von besonderem Interesse ist es, die vorteilhaften Eigenschaften unkonventioneller NMR-Kerne wie 19F und quadrupolarer Kerne 17O und 23Na zu nutzen und zu untersuchen, wie die physikalischen Eigenschaften biomolekularer Kondensate durch verschiedene biologische Regulationsfaktoren beeinflusst werden.
Weitere Einzelheiten entnehmen Sie bitte unseren Publikationen.
Proteindynamik in hochflexiblen Proteinsystemen
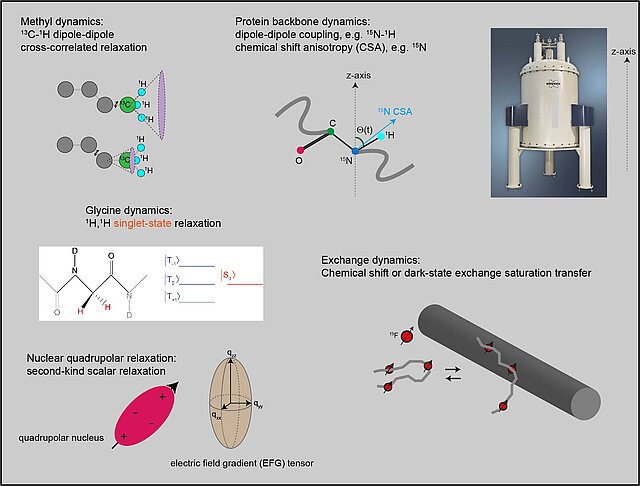
Die Funktion makromolekularer Maschinen in Zellen wird häufig durch das Vorhandensein intrinsisch ungeordneter Proteinregionen (IDP) unterstützt, deren Abstand und Reorientierungsdynamik die Zeitskala und Amplitude der relativen Mobilität der einzelnen Domänen bestimmen. Da es keine stabilen Tertiärstrukturen gibt, bilden die IDPs oft ein sehr heterogenes Konformationsensemble und erfahren eine Vielzahl von Bewegungen auf verschiedenen Längen- und Zeitskalen. Unsere Gruppe ist an der Entwicklung eines umfassenden konzeptionellen Rahmens und eines experimentellen Ansatzes interessiert, um Proteinbewegungen in IDPs in freier Form und im Kontext größerer Systeme aufzuklären. Die Hauptfronten unserer Forschung sind: a) die Überwindung der derzeitigen Größen- und Zeitskalenbeschränkungen von NMR-Methoden im Lösungszustand und b) die Integration der aus der NMR gewonnenen Informationen mit den ergänzenden Informationen aus anderen experimentellen und rechnerischen Techniken.
Weitere Einzelheiten entnehmen Sie bitte unseren Publikationen.

