Arbeitsgruppe Span

Unsere Arbeitsgruppe ist seit Dezember 2014 an der Heinrich-Heine-Universität Düsseldorf angesiedelt und seit Dezember 2015 werden wir vom Fonds der Chemischen Industrie gefördert. Der Schwerpunkt unserer Forschung liegt auf der Strukturaufklärung von Metalloproteinen sowie der Synthese und Charakterisierung artifizieller Metalloenzyme. Hierbei stehen Eisen-Schwefel-Proteine, deren Biosynthesewege und die Untersuchung ihrer katalytischen Eigenschaften im Fokus.
News
Dezember 2021 - Pünktlich zu Weihnachten erscheint unser Artikel zu DNAzymen in Nature!

DNA-Moleküle können viel mehr als nur genetische Informationen übertragen. Bestimmte DNA-Sequenzen neigen nicht zur Bildung einer Doppelhelix, sondern bilden eine ungewöhnliche dreidimensionale Struktur aus, die dem Molekül ermöglicht eine chemische Reaktion zu beschleunigen. Diese DNAzyme sind Biokatalysatoren mit einem enormen Potential für den Einsatz in der Therapie. In Zusammenarbeit mit den Arbeitsgruppen von Manuel Etzkorn, Holger Gohlke und Olav Schiemann haben wir zeitaufgelöste Einblicke in die Struktur dieser spannenden Biokatalysatoren erhalten. Ein DNAzym koppelt mit seinen Bindearmen gezielt an einen RNA-Strang und schneidet diesen dann im Bereich seines Kerns. Mittels hochauflösender Echtzeit-NMR, Elektronenspinresonanz, Fluoreszenzspektroskopie und Moleküldynamiksimulationen konnten die Struktur und katalytische Mechanismen des DNAzyms ermittelt werden.
Hier findet ihr den Artikel:
https://www.nature.com/articles/s41586-021-04225-4
Februar 2021 - Unser Artikel zu dem Eisen-Schwefel-Protein Asp1 ist jetzt online!

Das Protein Asp1 aus Schizosaccharomyces pombe ist ein bifunktionelles Enzym mit einer Kinase- und Pyrophosphatase-Aktivität und gehört sich der PPIP5K/Vip1 Familie. Die N-terminale Kinase-Domäne von Asp1 generiert spezifisch Inositolpyrophosphate (IPP), die einen hohen energiegehalt haben. Die C-terminale Pyrophosphatase-Domäne von Asp1 spaltet diese IPPs. Somit reguliert das Protein Asp1 die intrazellulären Level einiger spezifischer IPP-Moleküle, die wiederum viele biologische Prozesse, wie beispielsweise die Morphogenese der Zellen und die Transmission von Chromosomen. Wir haben zum ersten Mal gezeigt, dass die Pyrophosphatase-Domäne von Asp1 in der Zelle einen Eisen-Schwefel-Cluster bindet. Darüber hinaus haben wir durch Mutagenese die Liganden des Clusters identifiziert. Die Funktion und biologische Rolle des Clusters bleiben jedoch noch unbekannt.
Hier findet ihr den Artikel:
https://link.springer.com/article/10.1007/s00775-020-01840-w
Juli 2020 - Unser Review zu DNAzymen ist jetzt online!
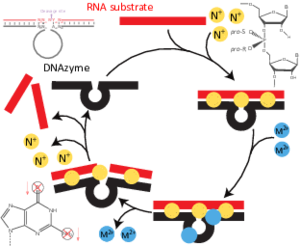
DNA-Moleküle können viel mehr als nur genetische Information speichern. Einzelsträngige DNA-Moleküle können eine ungewöhnliche dreidimentionale Konformation einnehmen und als DNA-Enzyme chemische Reaktionen katalysieren. Unser Übersichtsartikel "Molecular Features and Metal Ions That Influence 10-23 DNAzyme Activity" in der Zeitschrift Molecules fasst zusammen was wir über die Struktur und die Funktionsweise des 10-23 DNAzyms wissen.
Hier findet ihr den Artikel:
https://www.mdpi.com/1420-3049/25/13/3100
Juni 2020 - Unser Hydrogenase-Manuskript wurde in der Zeitschrift Angewandte Chemie publiziert!

Unser Artikel mit dem Titel "Caught in the Hinact: Crystal Structure and Spectroscopy Reveal a Sulfur Bound to the Active Site of an O2‐stable State of [FeFe] Hydrogenase" von Patricia Rodríguez-Maciá, Lisa M. Galle, Ragnar Bjornsson, Christian Lorent, Ingo Zebger, Yoshitaka Yoda, Stephen P. Cramer, Serena DeBeer, Ingrid Span und James A. Birrell wurde bei Angewandte Chemie Intl. Ed. veröffentlicht. Er wird bald auch in Deutsch erscheinen!
Vielen Dank an unsere großartigen Kooperationspartner aus den USA, Japan und Mülheim!
Hier findet ihr den Artikel:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202005208?af=R
März 2020 - Wir bleiben daheim!
Aufgrund der aktuellen Situation haben wir uns entschlossen bis auf Weiteres aus dem Homeoffice zu arbeiten. Um die Stimmung zu heben haben wir unsere schönsten Kristallbilder zusammengestellt! Wir hoffen, dass wir bald wieder ins Labor und ans Synchrotron können. Ihr könnt uns trotzdem jederzeit per E-Mail erreichen wenn ihr Fragen zu unserem Modul "Biomoleküle und Metallionen", unserem Seminar "Metals in Biology" oder Abschlussarbeiten habt.



Februar 2020 - Folgt uns auf Twitter #SpanLabHHU
Wenn ihr keine Neuigkeit rund um unsere Arbeitsgruppe und unsere Forschung verpassen wollt, könnt ihr uns auf Twitter folgen #SpanLabHHU
Februar 2020 - Unser Artikel zu der Kristallisation von Nukleinsäuren mit Hilfe des Proteins U1A ist online!

Das erste Paper von Hannah ist bei Journal of Structural Biology zur Veröffetnlichung angenommen und jetzt schon online:
https://www.sciencedirect.com/science/article/pii/S1047847720300435
Herlichlichen Glückwunsch Hannah!
November 2019 - Wir suchen einen Doktoranden für ein DFG-gefördertes Projekt auf dem Gebiet der [FeFe]-Hydrogenasen und biologische Wasserstoffherstellung

The Group of Jun.-Prof. Dr. Ingrid Span at the Institut für Physikalische Biologie at Heinrich-Heine-Universität Düsseldorf is seeking to fill a
PhD position in structural biology and bioinorganic chemistry (f/m/d)
for a DFG-funded project within the DFG Priority Program 1927 “Iron-Sulfur for Life”.
The successful candidate for this position will focus on studying the structure and molecular mechanisms of [FeFe] hydrogenases using X-ray crystallography in combination with biochemical and spectroscopic methods. For more information about our team and research please visit our homepage: www.ipb.hhu.de/unsere-teams/arbeitsgruppen/arbeitsgruppe-span.html.
Candidates should have a strong background in chemistry and biochemistry. Prior research experience in X-ray crystallography and metalloproteins is desirable but not required. Candidates should also have strong communication skills, the ability to conduct research, to prepare manuscripts and presentations independently, and the ability and willingness to work with graduate and undergraduate students in the laboratory.
Interested applicants who have (or are anticipated to have) a Master’s degree in biochemistry, chemistry, biophysics or a closely related discipline should send a short cover letter describing their research interests and motivation for joining the lab, Curriculum vitae, and contact information of two referees to Jun.-Prof. Dr. Ingrid Span (). Please feel free to contact me for questions regarding the position or detailed information on the project.

August 2019 - ICBIC-19
Im August waren Hannah und Ingrid auf der 19th International Conference on Biological Inorganic Chemistry (ICBIC-19).
Hannah hat ein Poster zu dem Thema "New variants of the protein U1A as helper for crystallization of nucleic acid complexes" vorgestellt und Ingrid einen Vortrag gehalten mit dem Titel "Sulfide protects [FeFe] hydrogenases from oxygen".
Tolle Konferenz vor spektakulärer Kulisse! (Danke an Rebeca Castillo für das Foto.)
Juli 2019 - DFG fördert unseren Antrag im Rahmen des Schwerpunktprogramm Iron-sulfur for Life!

Die DFG fördert unseren Antrag zum Thema "Correlation of three-dimensional and electronic structure of [FeFe] hydrogenases" in Zusammenarbeit mit der Arbeitsgruppe von Dr. James Birrell in der Abteilung Anorganische Spektroskopie am Max-Planck-Institut für Chemische Energiekonversion in Mülheim.
Mehr Informationen zu dem Schwerpunktsprogramm findet ihr hier: Iron-sulfur for Life
Juni 2018 - Unser Co-Rubredoxin-Manuskript wurde in der Zeitschrift Biological Chemistry publiziert!

Unser Artikel mit dem Titel "Spectroscopic characterization of the Co-substituted C-terminal domain of rubredoxin-2" von Lisa Galle, George Cutsail III, Volker Nischwitz, Serena DeBeer und Ingrid Span wurde bei Biological Chemistry veröffentlicht.
Hier findet ihr den Artikel:
![]() https://www.degruyter.com/view/j/bchm.2018.399.issue-7/hsz-2018-0142/hsz-2018-0142.xml
https://www.degruyter.com/view/j/bchm.2018.399.issue-7/hsz-2018-0142/hsz-2018-0142.xml
April 2018 - Frohe Ostern!


Februar 2018 - Unser Asp1-Manuskript ist jetzt online!
Aus unserer produktiven Zusammenarbeit mit Ursula Fleig und ihrer Arbeitsgruppe ist das Manuskript "Asp1 bi-functional activity modulates spindle function via controlling cellular inositol pyrophosphate levels in Schizosaccharomyces pombe" entstanden, welches jetzt online ist.
Hier findet ihr den Artikel:
http://mcb.asm.org/content/early/2018/02/08/MCB.00047-18.abstract
November 2017 - Neue Mikroskope für Proteinkristallographie!


Die erste Hürde bei der Proteinkristallographie ist es schöne, große, geordnete Kristalle zu bekommen. Mit unseren zwei neuen Mikroskopen der Firma Zeiss können wir unsere vielen Kristalle nicht nur anschauen sondern auch fotographieren.
September 2017 - Erste Messzeit am DESY!


Unser erster Trip ans Deutschen Elektronensynchrotron (DESY) in Hamburg war nicht nur lustig, sondern auch produktiv - die erste Kristallstruktur ist schon gelöst. Wir freuen uns schon auf die nächste Reise!
September 2017 - Steffen beginnt seine Promotion!

Steffen ist seit Anfang September Teil unserer Gruppe und wird die Effekte von Kobalt auf die Eisen-Schwefel-Cluster Biosynthese untersuchen. Willkommen!
Juli 2017 - Hannah erhält das Hoechst Doktorandenstipendium der Aventis Foundation!

Hannah wird für ihre hervorragenden Studienleistungen mit dem Hoechst Doktorandenstipendium ausgezeichnet. Dieses Stipendium wird nur einmal jährlich über die Stiftung Stipendien-Fonds des Verbandes der Chemischen Industrie (VCI) an eine Person vergeben. Herzlichen Glückwunsch!
Für mehr Infos: Hannah Rosenbach erhält das Hoechst Doktorandenstipendium der Aventis Foundation
Juni 2017 - Unser neues Cary 60 UV/Vis Spektrophotometer ist da!

Metalloproteine verfügen über elektronische Übergange im nahen UV und sichtbaren Bereich, wodurch sie für das menschliche Auge farbig erscheinen. Mit unserem neuen Cary Spektrophotometer können wir schnell und einfach die Umgebung des Metalls untersuchen.
April 2017 - Die Glovebox ist bereit für ihren ersten Einsatz!


Experimente mit Eisen-haltigen Proteinen benötigen eine kontrollierte Redoxumgebung, da Eisenionen von Luftsauerstoff oxidiert werden können. In ihrer oxidierten Form sind Eisenionen unlöslich und fallen aus der Reaktionslösung aus. Daher ist es für Eisenproteine besonders wichtig unter Sauerstoffausschluss zu arbeiten. Unsere Anaerobe Kammer von Coy Laboratories, kurz Glovebox genannt, verfügt über eine anaerobe Atmosphäre, die aus 95% Stickstoff und 5% Wasserstoff besteht. Im Inneren der Box befinden sich auch eine ÄKTA Start für Proteinaufreinigung unter Sauerstoffausschluss.
Informationen für Studenten
Wenn ihr Interesse an einem Forschungspraktikum oder einer Bachelor-/Masterarbeit habt meldet euch per E-Mail an

